Réponse
Les nodules observés, de petite taille, sont localisés, circonscrits
et font évoquer d’emblée des tumeurs bénignes.
Les diagnostics évoqués ont été fibromes, verrues, neurofibromes
ou fibro-xanthomes. Les verrues et neurofibromes
paraissaient peu probables en absence de lésions
cutanées associées ou de contexte d’immuno-dépression
pouvant justifier la présence de multiples lésions buccales
à human papilloma virus (hpv).
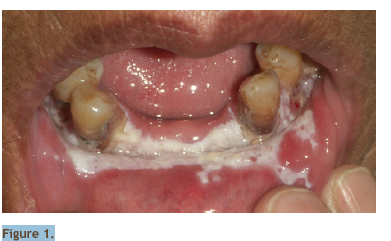
Cinq nodules de la pointe de la langue ont été enlevés
sous anesthésie locale et adressés à l’anatomopathologiste
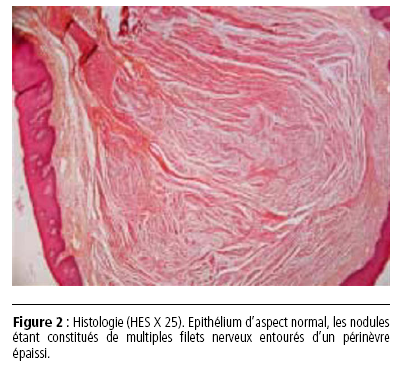
(fig. 2). Le compte-rendu note un épithélium
d’aspect normal, les nodules étant constitués de multiples
filets nerveux entourés d’un périnèvre épaissi. Ce caractère
permet d’exclure le diagnostic de névromes solitaires.
Le diagnostic retenu est celui de névromes myéliniques,
évoquant une maladie héréditaire pouvant associer ce
tableau à un cancer médullaire thyroïdien. Lors de la con
Les nodules observés, de petite taille, sont localisés, circonscrits
et font évoquer d’emblée des tumeurs bénignes.
Les diagnostics évoqués ont été fibromes, verrues, neurofibromes
ou fibro-xanthomes. Les verrues et neurofibromes
paraissaient peu probables en absence de lésions
cutanées associées ou de contexte d’immuno-dépression
pouvant justifier la présence de multiples lésions buccales
à human papilloma virus (hpv).
Cinq nodules de la pointe de la langue ont été enlevés
sous anesthésie locale et adressés à l’anatomopathologiste
(fig. 2). Le compte-rendu note un épithélium
d’aspect normal, les nodules étant constitués de multiples
filets nerveux entourés d’un périnèvre épaissi. Ce caractère
permet d’exclure le diagnostic de névromes solitaires.
Le diagnostic retenu est celui de névromes myéliniques,
évoquant une maladie héréditaire pouvant associer ce
tableau à un cancer médullaire thyroïdien. Lors de la con
consultation
de contrôle, la patiente confirme ce diagnostic,
aboutissement de l’exploration signalée. Elle est prise en
charge en endocrinologie pour complément de bilan et
traitement.
L’association d’une neurofibromatose de von Reclinghausen
et d’un phéochromocytome est relativement
courante, mais les névromes muqueux multiples sont toujours
associés aux signes cutanés de cette maladie, et la
distribution des lésions muqueuses est différente. L’association
de multiples neurofibromes muqueux à un phéochromcytome
et à un carcinome médullaire thyroïde fait
partie des syndromes des néoplasies endocrines multiples
(« multiple endocrine neoplasia syndrome » ou « MEN
syndrome »). Trois types différents sont actuellement distingués.
Le cas présenté correspond au IIb associant à la
triade décrite une hyperplasie des nerfs cornéens. Habituellement,
les névromes muqueux apparaissent longtemps
avant les pathologies malignes associées dans ces
syndromes, ce qui présente un réel intérêt de dépistage.
L’étio-pathogénie de ces multiples néoplasies endocrines
s’explique par un trouble métabolique survenant lors
de la migration des cellules d’origine neuro-ectodermique
à partir des crêtes neurales, les unes se différenciant en
cellules glandulaires, les autres en tissus nerveux.
RÉFÉRENCES
1. Jain S, Watson MA, DeBenedetti MK, Hiraki Y, Moley JF,
Milbrandt J. Expression profiles provide insights into early malignant
potential and skeletal abnormalities in multiple endocrine
neoplasia type 2B syndrome tumors. Cancer Res, 2004;64:
3907-13.
2. Lee NC, Norton JA. Multiple endocrine neoplasia type IIb.
Genetic basis and clinical expression. Surg Oncol, 2000;9:111-8.
3. Edwards M, Reid JS. Multiple endocrine neoplasia syndrome
type IIb: a case report. Int J Paediatr Dent, 1998;8:55-60.
4. Cribier B, Grosshans E. Tumeurs cutanées nerveuses rares. Ann
Dermatol Venereol, 1997;124:280-95.
5. Joshi VV, Silverman JF. Pathology of neuroblastic tumors. Sem
Diagn Pathol, 1994;11:107-17.
6. Ayala F, DeRosa G, Scippa L, Vecchio P. Multiple endocrine neoplasia,
type IIb. Dermatologica, 1981;162:292-9.
7. Rashid M, Khairi A, Dexter RN, Burzynski NJ, Johnson CC. Mucosal
neuroma, pheochromocytoma and medullary thyroid carcinoma:
multiple endocrine neoplasia. Medicine, 1975;54: 89-112.
de contrôle, la patiente confirme ce diagnostic,
aboutissement de l’exploration signalée. Elle est prise en
charge en endocrinologie pour complément de bilan et
traitement.
L’association d’une neurofibromatose de von Reclinghausen
et d’un phéochromocytome est relativement
courante, mais les névromes muqueux multiples sont toujours
associés aux signes cutanés de cette maladie, et la
distribution des lésions muqueuses est différente. L’association
de multiples neurofibromes muqueux à un phéochromcytome
et à un carcinome médullaire thyroïde fait
partie des syndromes des néoplasies endocrines multiples
(« multiple endocrine neoplasia syndrome » ou « MEN
syndrome »). Trois types différents sont actuellement distingués.
Le cas présenté correspond au IIb associant à la
triade décrite une hyperplasie des nerfs cornéens. Habituellement,
les névromes muqueux apparaissent longtemps
avant les pathologies malignes associées dans ces
syndromes, ce qui présente un réel intérêt de dépistage.
L’étio-pathogénie de ces multiples néoplasies endocrines
s’explique par un trouble métabolique survenant lors
de la migration des cellules d’origine neuro-ectodermique
à partir des crêtes neurales, les unes se différenciant en
cellules glandulaires, les autres en tissus nerveux.
RÉFÉRENCES
1. Jain S, Watson MA, DeBenedetti MK, Hiraki Y, Moley JF,
Milbrandt J. Expression profiles provide insights into early malignant
potential and skeletal abnormalities in multiple endocrine
neoplasia type 2B syndrome tumors. Cancer Res, 2004;64:
3907-13.
2. Lee NC, Norton JA. Multiple endocrine neoplasia type IIb.
Genetic basis and clinical expression. Surg Oncol, 2000;9:111-8.
3. Edwards M, Reid JS. Multiple endocrine neoplasia syndrome
type IIb: a case report. Int J Paediatr Dent, 1998;8:55-60.
4. Cribier B, Grosshans E. Tumeurs cutanées nerveuses rares. Ann
Dermatol Venereol, 1997;124:280-95.
5. Joshi VV, Silverman JF. Pathology of neuroblastic tumors. Sem
Diagn Pathol, 1994;11:107-17.
6. Ayala F, DeRosa G, Scippa L, Vecchio P. Multiple endocrine neoplasia,
type IIb. Dermatologica, 1981;162:292-9.
7. Rashid M, Khairi A, Dexter RN, Burzynski NJ, Johnson CC. Mucosal
neuroma, pheochromocytoma and medullary thyroid carcinoma:
multiple endocrine neoplasia. Medicine, 1975;54: 89-112.